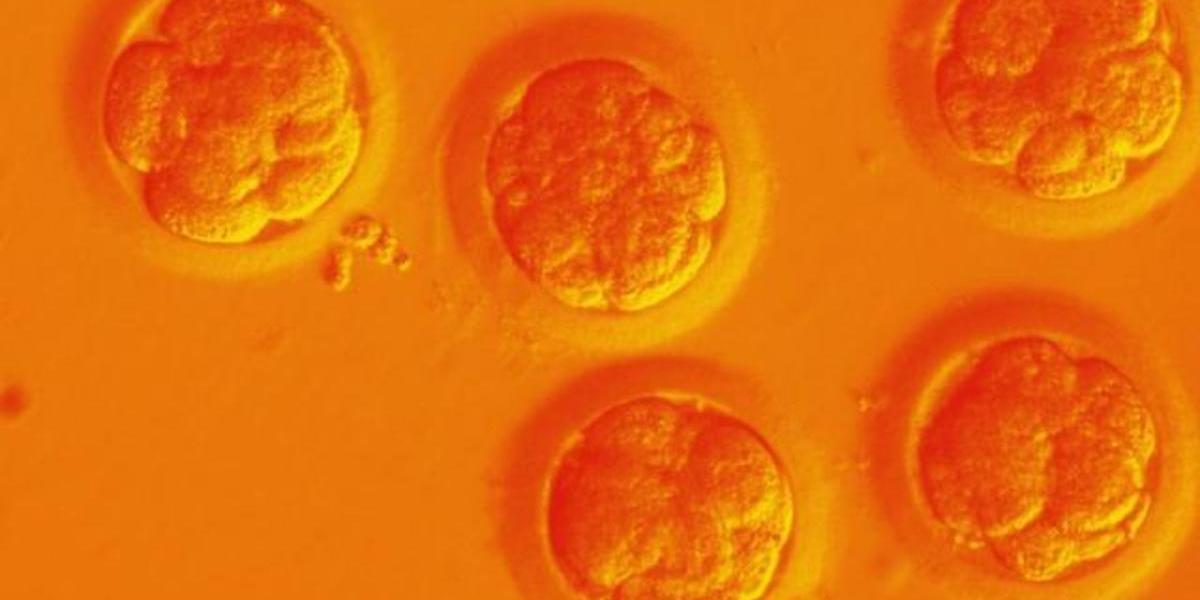
北京時間6月3日,《自然-醫學》(Nature Medicine)發表的一項研究通過超過40萬人的樣本分析發現,攜帶兩個CCR5基因突變拷貝的個體死亡率會增加21%。
要知道,當時賀建奎基因編輯嬰兒的前提是為了對抗HIV,但他對CCR5基因進行編輯的後果沒有考慮周全。也就是說,依據最新論文的結論,即使賀建奎完全實現其實驗預期,那麼極大概率會導致嬰兒面對更高的健康風險。
大樣本得出的結論

2018年,賀建奎宣佈使用CRISPR技術得到了一對CCR5基因改造的活產胎兒,他引入這些突變是為了模仿自然發生的CCR5-Δ32突變,他希望得到的結果是,每個胎兒攜帶兩個CCR5基因突變拷貝,並且每個拷貝缺失32個堿基對。
術語CCR5-Δ32突變的意思是,基因拷貝發生了32個堿基對的缺失。CCR5基因編碼一種人體細胞表面稱作CCR5的蛋白質,這種蛋白質是HIV的入侵位點,相當於HIV進入人體免疫細胞的“門把手”。而部分人群的CCR5基因發生了CCR5-Δ32突變,突變後的蛋白CCR5就失去了細胞表面的部分,“門把手”掉了,HIV也就難以侵入細胞。
人的基因一份來自父親,一份來自母親,所以人的基因都是成對出現的。如果某人的兩個CCR5基因都發生了CCR5-Δ32突變(純合子),那麼他就擁有了一部分對抗HIV的能力。只有一個CCR5基因突變(雜合子)是無法對抗HIV的。
然而賀建奎並未注意到,既往研究發現這一突變的攜帶者可能存在感染致命流感的風險。
比如一項2015年發表在《普通病毒學》(Journal of General Virology)的研究。西班牙學者分析了2009年大流感時期的171個呼吸道樣本,結果顯示,CCR5突變型(包括純合子和雜合子)患者死亡率是17.4%,遠高於CCR5野生型(正常)患者死亡率的4.7%,也就是說,CCR5突變型人群有可能更容易感染致命流感。只是該研究的缺陷在於樣本量太少,說服力不夠強。
這次發表在《自然-醫學》的研究給出了一個更有說服力的流行病學結論。研究作者是來自加州大學伯克利分校整合生物學系(Integrative Biology)的魏馨竹博士和Rasmus Nielsen教授,他們分析了英國生物樣本庫(UK Biobank)中超過40萬人的基因型和死亡登記資訊。
巨大的樣本量是本次研究的優勢,說服力也更強。英國生物樣本庫是一個大型的前瞻性人口群體,該庫通過問卷和護士問詢收集了50萬人的遺傳、身體和健康資料。
魏馨竹認為,英國生物樣本庫是遺傳學家鍾愛的資料庫,也是進行這項研究的最佳選擇。這不僅因其資料全面,也因為CCR5突變主要在歐洲人群中常見,這個遺傳背景對這項研究來說很有幫助。
CCR5突變型人群在英國人口的比例為11.59%,其中攜帶兩個CCR5-Δ32突變拷貝的個體約為1%。英國生物庫中攜帶兩個CCR5基因突變拷貝的個體有4349人,攜帶1個CCR5基因突變拷貝的個體有83038人,正常CCR5基因的個體是308317人,這就提供了將這些個體的死亡率進行野生型、突變雜合型和突變純合型比較的機會。
分析發現,相比那些沒有或只有一個CCR5-Δ32突變拷貝的個體,攜帶兩個CCR5-Δ32突變拷貝的個體在76歲之前死亡的可能性增加了21%。他們的研究結果表明,在沒有HIV感染的情況下,CCR5-Δ32突變對個體的健康影響是負面的。
依據這個結論推理,賀建奎研究如果完全實現基因編輯目標的話,也就是兩個嬰兒都分別攜帶兩個CCR5-Δ32突變拷貝個體的話,其健康風險將提高。
不夠完美的流行病學研究

此前有看法稱,雖然賀建奎的基因編輯嬰兒有多個硬傷,但至少編輯CCR5基因成功的話不會給嬰兒帶來什麼風險。
這次魏馨竹等人發表在《自然-醫學》上的研究反駁了這種看法,即正常的CCR5蛋白其實是有生理功能的,如果將其突變失去原有功能的話,將會產生眾多未知的非預期效應。
新的研究結果表明,在人體內引入突變的非預期結果會如何影響人類健康還有待進一步認識。
只有一個CCR5-Δ32突變拷貝個體的死亡率並不比正常個體的死亡率高,Rasmus Nielsen認為,這很可能是因為只要有一個CCR5基因的正常拷貝,其免疫功能就會大部分得到保留。
Rasmus Nielsen表示,僅就目前掌握的知識看,在對CCR5基因突變的全部影響知之甚少的時候引入突變是非常危險的,它很可能不會是你想要的結果,並且很可能是一個糟糕的結果。尤其值得注意的是,對基因的兩個拷貝同時突變可能更加危險,滅活功能性蛋白很可能產生負面影響。
不過,新的研究尚有不足。分子藥理學博士陳達維曾經在多家跨國藥企負責精准醫學研究,在他看來,加州大學伯克利分校研究人員的論文僅引用了2015年的西班牙研究的結論。2015年的西班牙研究的樣本太小,屬於很初步的探索性研究,不僅結論遠遠不確定,而且也和分別來自巴西人群和義大利人群的研究結論不一致,後兩者認為CCR5-Δ32突變與流感感染並無關聯。
新研究關注的是英國生物樣本庫中攜帶兩個CCR5-Δ32突變拷貝的個體死亡率,而且認為只有純合子才與致死(存活)率相關,這與2015年的研究關注點不同,後者關注的是CCR5-Δ32突變與流感死亡率的關係,並認為CCR5-Δ32突變雜合子也關聯感染致命流感的結論,因此兩個研究結論存在衝突,很難互相支持。
陳達維對DeppTech表示,加州大學伯克利分校研究人員得到的固然是一個有趣的結果,但一個基因的變異能夠明顯影響總死亡率這樣複雜的臨床現象,應該是一個罕見的人類遺傳學結果,更需要額外獨立的研究來驗證。
賀氏研究硬傷累累
撇開這次新研究,也不論倫理道德問題,僅在科學和技術層面來看,賀建奎研究的倒掉就已經蓋棺定論。
其一,賀建奎的基因編輯嬰兒其實在技術上是完全失敗的。
據賀建奎的說法,兩個嬰兒中,露露的兩個CCR5基因中只編輯成功了一個,而娜娜的兩個CCR5基因都成功修飾,他認為娜娜已經獲得了HIV保護。只有一個基因發生CCR5-Δ32突變是不能抵抗愛滋病毒入侵的。
仔細分析賀建奎在香港第二屆人類基因組編輯國際峰會上公佈出來的基因序列後,生物化學博士方舟子認為,賀建奎所編輯的3個基因沒有一個是成功去掉了32個堿基對的。方的博士學位就是HIV有關的研究。
且不論露露的情況,娜娜的第一個突變插入了1個堿基對,第二個突變少掉了4個堿基對,這可能造成兩個基因無法進行蛋白質製造,所以娜娜可能沒有任何CCR5。
還有一種情況是,同一個胚胎中,有的胚胎細胞的編輯成功,有的胚胎細胞沒有被編輯,這樣就導致了人體存在沒編輯的細胞和編輯過的細胞,成為嵌合體。
其二,編輯CCR5基因並不能夠完全防止HIV的感染。這是因為CCR5-Δ32突變並不能對抗所有的HIV,而是只能對抗某種類型的HIV。有的HIV可以通過T細胞上的其他受體入侵。
其三,在目前的醫學實踐上已經有了比賀建奎的方法更有效、更實用的醫學手段防止胎兒感染HIV。並且,即使人們不幸感染了HIV,如今也能通過藥物控制,可以過上正常的生活。
其四,對於娜娜和露露來說,其父親是HIV感染者,目前是HIV陰性,兩個嬰兒天生獲得愛滋病的風險並不大,而CCR5並非致病基因而是正常基因。賀建奎實際上是為了預防後天的小概率事件而修改了一個有重要功能的正常基因。
加上這次加州大學伯克利分校的研究,陳達維得出的結論是,改變任何胚胎基因的臨床價值還非常不清楚,賀建奎的研究更不是説明HIV陽性父母生育不帶病毒後代的臨床手段。
新研究適用於華人嗎?
CCR5-Δ32突變並非是人類為了對抗HIV感染而進化出來的。Rasmus Nielsen認為,愛滋病是上世紀80年代以來才開始大規模傳播,而CCR5-Δ32突變在北歐人中一直比較常見,因此這是其他自然選擇的結果
今年2月,《細胞》雜誌(Cell)的一項研究稱,CCR5-Δ32突變與中風後記憶的恢復有關,這意味著它也可能在改變大腦功能方面發揮作用。
但CRISPR的開創者、麻省理工學院教授張鋒在接受《麻省理工科技評論》採訪時表示,基於片面的資訊去改造人的生殖細胞是不負責任的。
發生兩個基因CCR5-Δ32突變在歐洲人群中較為常見,這種人的比例大約為1%,而這種突變在亞洲人群中較為少見。那麼問題來了,這項針對英國人樣本的研究對中國人有什麼借鑑嗎?
對此魏馨竹認為,由於突變的影響取決於遺傳背景和環境因素,我們無法推測CCR5-Δ32突變對東亞人群的影響。
不過多位專家在接受DeepTech採訪時表示,由於華人並不是一個特別人種,有沒有華人樣本庫並不那麼重要。
當然,除了流行病學調查還有別的研究手段,還可以通過體外實驗、動物實驗來研究CCR5-Δ32突變的影響。
本文係由DeepTech深科技授權刊登。原文連結:贺建奎实验的“致命”问题:基因编辑女婴未来或会折寿