民進黨立委何欣純詢問高端疫苗何時開始進行緊急授權審查,陳時中表示,要等AZ疫苗的抗體效價出來才能做比對,預計在6月底開始進行審查,但無法預設需要多久時間,這部分要由委員會判斷,強調食藥署審查各方面都很嚴格,甚至還被說太嚴格;至於日前中央流行疫情指揮中心公布8月底前一週至少可以打100萬劑,陳時中表示,規劃可以打130萬劑到170萬劑,現在只需擔心疫苗能否如期到貨,如果大量進來就有信心能有秩序地打完。
民眾黨立委高虹安則針對疫苗的保護力進行詢問,指出總統蔡英文聲稱會遵照國際標準檢驗,但食藥署公布的EUA評估標準,雖然宣稱是參照美國FDA的指引,但卻沒有比照50%以上的保護力,陳時中表示,保護力50%以上的相關疫苗,其綜合抗體及其他表線是否有等同性,交由審查委員會專家就科學資料研判。高虹安質疑,這樣一來要如何保證疫苗的保護力?陳時中回應,這部分根據EUA緊急公共衛生事件醫療需求,看需求怎麼樣,審查委員會據科學資料做相關認定,強調是靠審查委員會的決定。
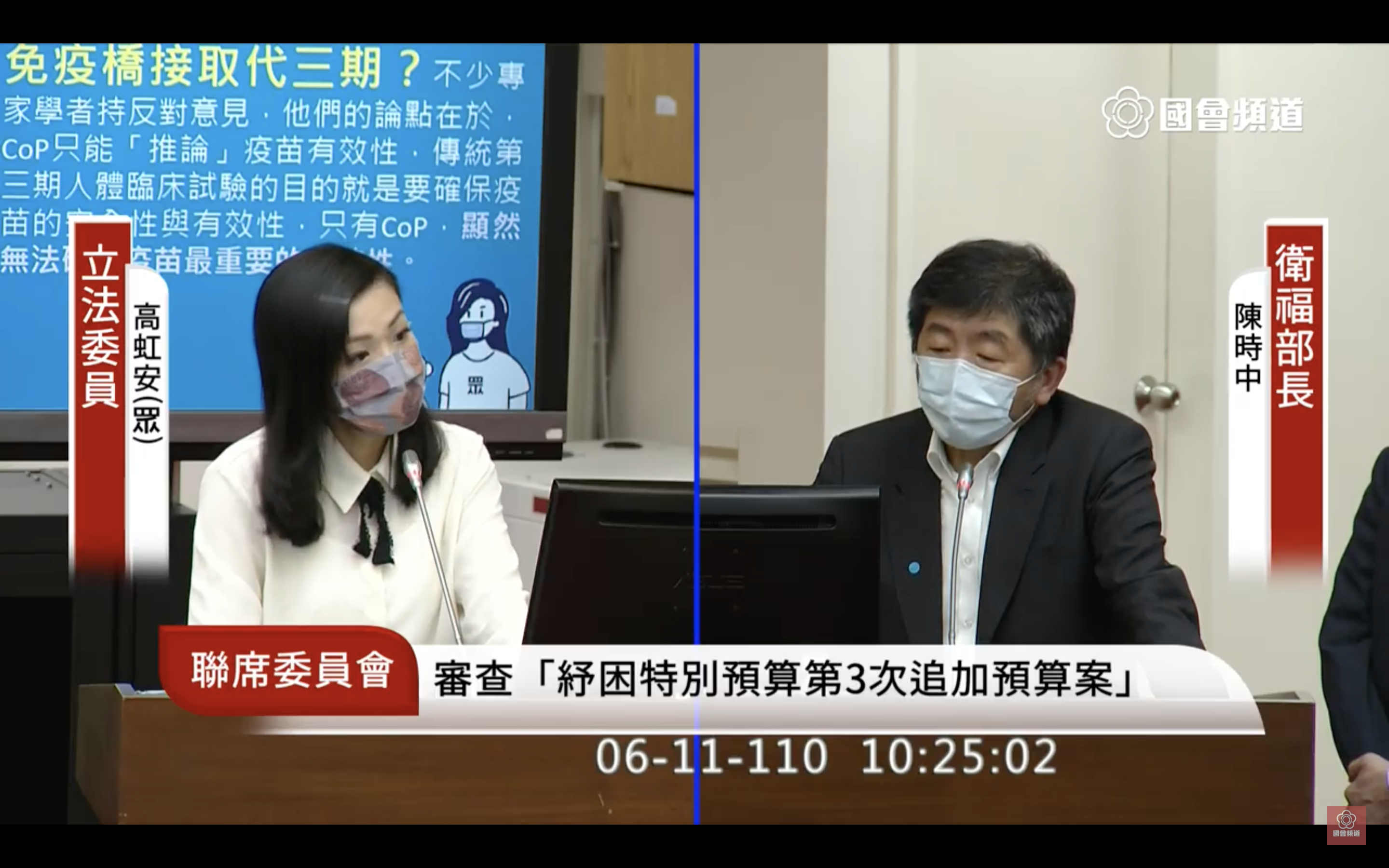
高虹安接著表示,高端未來將以「免疫橋接」取代第三期試驗,國際上是否有這樣的先例?陳時中坦言,不清楚是否有正在進行中的國家,雖然WHO一直有在討論,但目前沒有一個新冠肺炎疫苗是透過這種方式通過緊急授權的。高虹安說,這根本就不是國際標準,沒有其他國家有用過,希望食藥署能跟人民站在一起,扮演好監督的角色,讓疫苗打到身體裡是有足夠保護力的,而政府已經先購買了1,000萬劑國產疫苗,代表會有500萬人打到,若是保護力不如預期,解封後疫情恐會再度爆發,直指「就像穿國王的新衣一樣,根本沒有達到預期保護力。」
高虹安另指出,美國FDA審查輝瑞、莫德納、嬌生疫苗時,用線上直播的方式公開辦理,詢問國產疫苗是否也能比照相同模式,以消除國人疑慮,陳時中表示,這部分需要尊重審查委員會,若審查委員想要這樣做就沒問題,不過目前是沒有這個打算,他認為讓委員在不受外界壓力下做的學術探討,比較能產生公正結果。